文章来源:IQVIA艾昆维
近年来,全球药物研发逐步转向以患者为中心的理念。这一转变不仅是源于政策推动,也是因患者需求变化和技术进步而形成的必然趋势。CDE(中国国家药品监督管理局药品审评中心)和FDA(美国食品药品监督管理局)在这一理念上的高度一致性,也促使申办方需要尽早理解政策导向并及时做出相应调整。本文旨在总结和梳理FDA和CDE的相关政策,深入了解其指导方向及具体实施指导。
01 FDA以患者为中心药物研发相关政策梳理
2006年,FDA发布了《关于患者自报结果应用于新药研发和疗效评价的指南(草案)》,首次鼓励在临床疗效评价与药物试验报告中包含患者报告结局(PRO),以测量干预措施对患者健康状况的影响10。以此为起点,2018年至2023年间,四部以患者为中心的药物研发(PFDD)指南系统逐步成熟。在历时17年的过程中,FDA推动全球制药企业将研发重点锚定于实际临床需求,实现从“申办方主导”向“患者赋权”的过渡。
FDA以患者为中心的药物研发政策概览

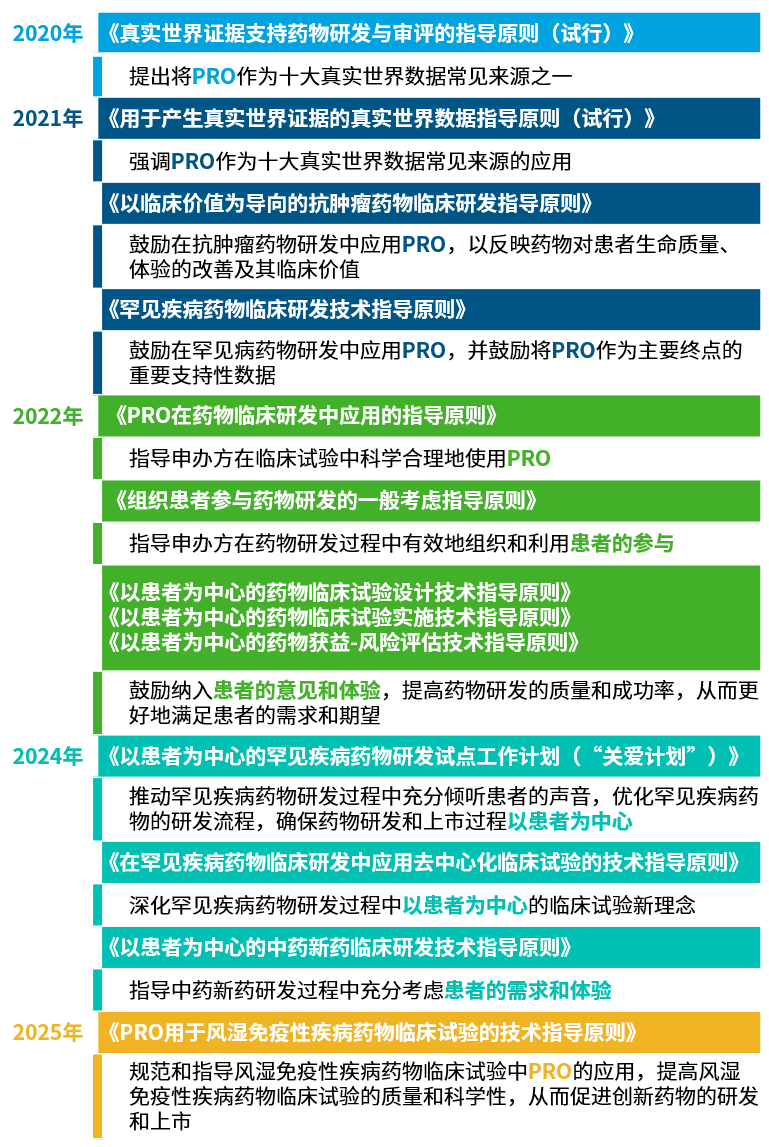
02 CDE以患者为中心药物研发相关政策梳理
2020年,CDE在《真实世界证据支持药物研发与审评的指导原则(试行)》中首次将PRO纳入十大真实世界数据来源之一19。2022年成为关键转折年,从首个PRO专项指导文件到PFDD三部曲,PRO成为我国药品审评审批的重要指标之一,试验设计到实施全链条绑定患者需求,实现“患者需求-数据采集-审评决策”闭环20,21。CDE以政策推动行业转型——当疗效终点由实验室指标转向患者实际获益,中国创新药的竞争规则得以重新定义。
CDE以患者为中心的药物研发政策概览
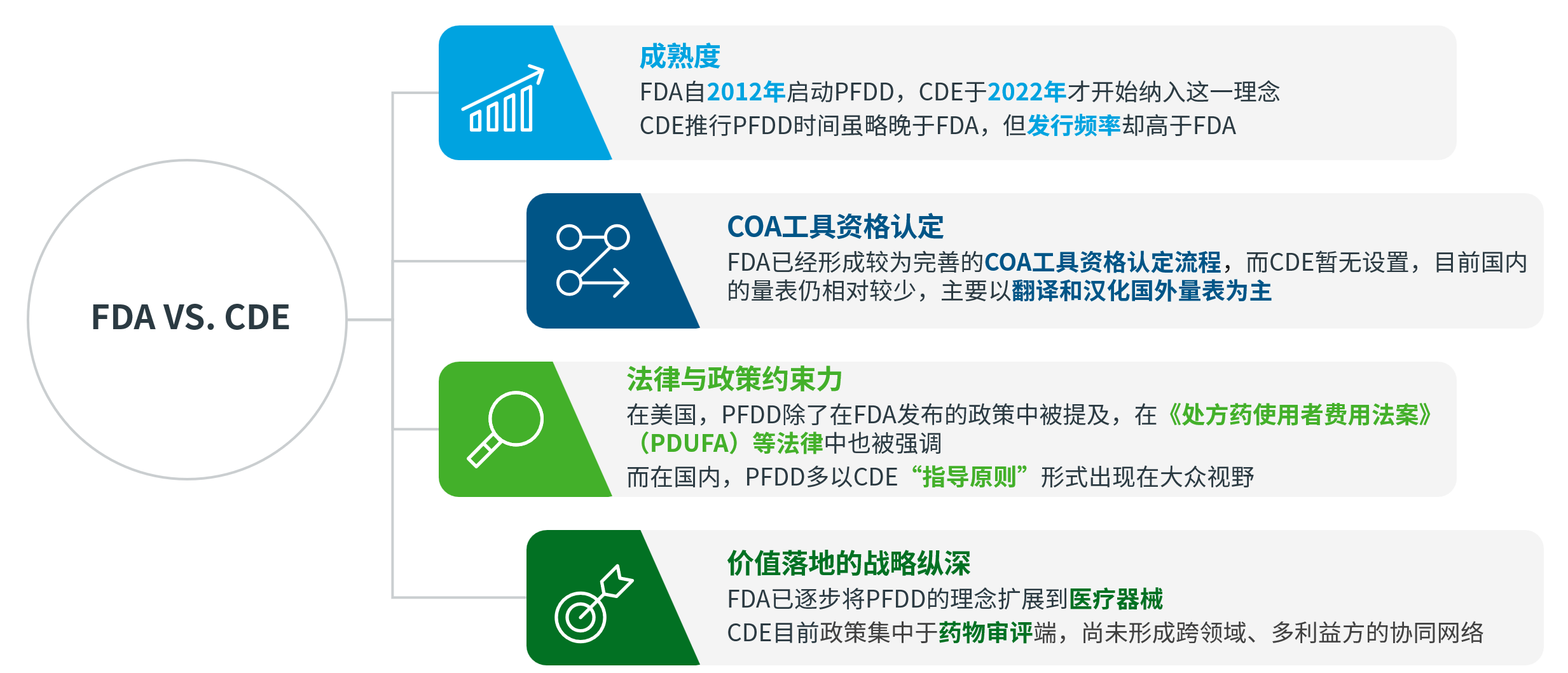
03 FDA对比CDE:以患者为中心药物研发相关政策异同点
总体而言,FDA和CDE在以患者为中心的药物研发政策上“同”大于“异”,主要包括:
两者都提倡“以患者为中心的药物研发”,强调关注患者需求,将患者视为积极参与者,并涵盖药物生命周期的各个阶段。
FDA和CDE建议申办方在药物全生命周期中的多个环节收集患者体验数据,包括但不限于临床结果评估(COA)、定性数据(例如访谈)、定量数据(例如调查问卷)。
对于PED收集的方法和质量提出具体要求,并发布了相应的技术指南,尤其是COA部分,涉及到新COA开发、已有COA翻译、文化调试以及改进流程和标准。
FDA与CDE在患者为中心药物研发中的政策差异
04 结语:未来竞争的核心
以患者为中心的发展趋势对申办方提出了更高的要求。及时响应政策的号召,快速做出调整,已成为申办方成功的重要考量。在政策优先级领域(如肿瘤、自身免疫疾病),申办方可以通过患者参与的临床试验设计(如调整终点指标、优化随访流程)来回应未被满足的临床需求。同时,可以将“患者声音”转化为监管认可的证据(如COA、定性数据、定量数据),从而在疗效竞争中脱颖而出,并在同类产品中建立独特的疗效证明力。后续我们还将分享欧美地区的实践经验,助力加速中国“以患者为中心药物研发”的落地,敬请期待!
参考文献
1. FDA. 21st Century Cures Act. FDA. https://www.fda.gov/regulatory-information/selected-amendments-fdc-act/21st-century-cures-act (accessed 2025-02-25).
2. FDA. Core Patient-Reported Outcomes in Cancer Clinical Trials. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/core-patient-reported-outcomes-cancer-clinical-trials (accessed 2025-02-25).
3. FDA. Developing and Submitting Proposed Draft Guidance Relating to Patient Experience Data. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/developing-and-submitting-proposed-draft-guidance-relating-patient-experience-data (accessed 2025-02-25).
4. FDA. Incorporating Voluntary Patient Preference Information over the Total Product Life Cycle. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/incorporating-voluntary-patient-preference-information-over-total-product-life-cycle (accessed 2025-02-25).
5. FDA. Patient-Focused Drug Development: Collecting Comprehensive and Representative Input. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/patient-focused-drug-development-collecting-comprehensive-and-representative-input (accessed 2025-02-25).
6. FDA. Patient-Focused Drug Development: Incorporating Clinical Outcome Assessments Into Endpoints for Regulatory Decision-Making. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/patient-focused-drug-development-incorporating-clinical-outcome-assessments-endpoints-regulatory (accessed 2025-02-25).
7. FDA. Patient-Focused Drug Development: Methods to Identify What Is Important to Patients. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/patient-focused-drug-development-methods-identify-what-important-patients (accessed 2025-02-25).
8. FDA. Patient-Focused Drug Development: Selecting, Developing, or Modifying Fit-for-Purpose Clinical Outcome Assessments. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/patient-focused-drug-development-selecting-developing-or-modifying-fit-purpose-clinical-outcome (accessed 2025-02-25).
9. FDA. Submitting Patient-Reported Outcome Data in Cancer Clinical Trials. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/submitting-patient-reported-outcome-data-cancer-clinical-trials (accessed 2025-02-25).
10. U.S. Department of Health and Human Services FDA Center for Drug Evaluation and Research. Guidance for Industry: Patient-Reported Outcome Measures: Use in Medical Product Development to Support Labeling Claims: Draft Guidance. Health and Quality of Life Outcomes 2006, 4 (1), 79. https://doi.org/10.1186/1477-7525-4-79.
11. 国家药监局药审中心关于发布《用于产生真实世界证据的真实世界数据指导原则(试行)》的通告(2021年第27号). Center for Drug Evaluation, NMPA. https://www.cde.org.cn/main/news/viewInfoCommon/2a1c437ed54e7b838a7e86f4ac21c539 (accessed 2025-02-23).
12. 国家药监局药审中心关于发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》的通告(2021年第46号). https://www.cde.org.cn/main/news/viewInfoCommon/ef7bfde96c769308ad080bb7ab2f538e (accessed 2025-02-25).
13. 关于公开征求《罕见疾病药物临床研发技术指导原则》意见的通知. https://www.cde.org.cn/main/news/viewInfoCommon/c8ab88e8573500b49c1d48853ab8b4fc (accessed 2025-02-25).
14. 国家药监局药审中心关于发布 《组织患者参与药物研发的一般考虑指导原则(试行)》的通告(2022年第46号). https://www.cde.org.cn/main/news/viewInfoCommon/41c7a683e4d0dcca28bccadc47096d2a (accessed 2025-02-25).
15. 国家药监局药审中心关于发布《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》的通知(药审业〔2024〕500号). https://www.cde.org.cn/main/news/viewInfoCommon/244dc3661a418359aa12d7cba9bacf5d (accessed 2025-02-25).
16. 国家药监局药审中心关于发布《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》的通告(2024年第25号). https://www.cde.org.cn/main/news/viewInfoCommon/e5b3409ea38fbc8254bb0635d004c73d (accessed 2025-02-25).
17. 关于公开征求《以患者为中心的中药新药临床研发技术指导原则(征求意见稿)》意见的通知. https://www.cde.org.cn/main/news/viewInfoCommon/30f691f037464f4f920b8aa8208793f1 (accessed 2025-02-25).
18. 国家药监局药审中心关于发布《患者报告结局指标用于风湿免疫性疾病临床试验的技术指导原则》的通告(2025年第10号). https://www.cde.org.cn/main/news/viewInfoCommon/2333a5e1f8f2f932626d2c2e04506477 (accessed 2025-02-25).
19. 关于公开征求《真实世界证据支持药物研发的基本考虑》意见的通知. https://www.cde.org.cn/main/news/viewInfoCommon/7e6fb9fc3f066a966a02130f24dbff1c (accessed 2025-02-25).
20. 国家药监局药审中心关于发布《患者报告结局在药物临床研发中应用的指导原则(试行)》的通告(2021年第62号). Center for Drug Evaluation, NMPA. https://www.cde.org.cn/main/news/viewInfoCommon/c2f79c22e8678241b030c71523eb300c (accessed 2025-02-23).
21. 国家药监局药审中心关于发布 《以患者为中心的药物临床试验设计技术指导原则(试行)》《以患者为中心的药物临床试验实施技术指导原则(试行)》《以患者为中心的药物获益-风险评估技术指导原则(试行)》的通告(2023年第44号). Center for Drug Evaluation, NMPA. https://www.cde.org.cn/main/news/viewInfoCommon/42c008e28f7004cd19b73949142380bd (accessed 2025-02-23).
免责声明 本文系转载,仅做分享之用,不代表平台观点。图片、文章、字体版权等均属于原作者所有,如有侵权请告知,我们会及时处理。
原文链接:https://mp.weixin.qq.com/s/Rl4tIJKFZF9sLmIcJ2S_yQ