文章来源:药渡
随着2024 ICH展望会全体大会在苏州的隆重召开,国家药监局(NMPA)在加入ICH的第七个年头,再次展示了在全面落实ICH指导原则方面取得的重大成就。这一里程碑式的事件不仅为全球患者提供了更高标准的药品,也为中国制药企业的国际化步伐铺平了道路。
本次会议吸引了业界广泛关注,参会人员纷纷就中国药品监管的国际化进程展开热烈讨论。
本文全面梳理回顾了2024年度中国转化实施ICH指导原则的现状,旨在帮助读者更好地了解中国药品监管国际化的最新进展。需要注意的是,由于信息更新的快速性,本文所梳理的ICH指导原则现状可能存在遗漏。如有任何补充或更新,欢迎在评论区留言。
一 2024年度中国转化实施ICH指导原则情况
药品质量和安全是保障民众健康的基石。为了与国际药品监管标准接轨,中国药品监督管理局(NMPA)自国际人用药品注册技术协调会(ICH)成立以来,始终与其保持紧密合作,致力于将ICH的指导原则在国内落地实施。在ICH指导原则的接受、理解和应用方面,中国已取得积极进展。
尽管在实施过程中面临不少挑战,但NMPA正通过加强培训、组织研讨以及推进实施工作,努力提升监管机构、学术界和工业界之间的沟通与协作,以确保ICH指导原则在中国得到有效实施。截至2024年5月底,NMPA在2024年度已发布近3个关于转化实施ICH指导原则的公告,涉及ICH指导原则清单及发布时间如下:
1. 强化药物中DNA反应性杂质评估

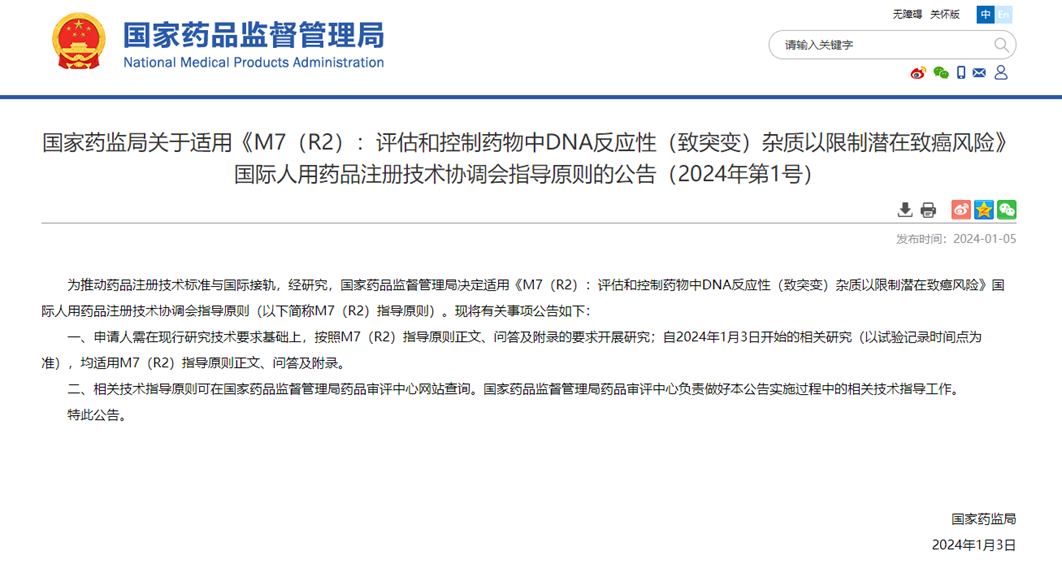
2024年1月5日,国家药品监督管理局(NMPA)正式发布了关于《M7(R2):评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险》的公告(2024年第1号)。
此举旨在进一步规范药品研发和生产流程,确保公众用药安全。根据新公告,所有药品申请人需在现行研究技术要求的基础上,严格按照M7(R2)指导原则的正文、问答及附录要求进行相关研究。此举将加强对药物中可能存在的DNA反应性杂质的评估和控制,以最大限度降低潜在致癌风险。
自2024年1月3日起(以试验记录时间点为准)进行的相关研究,均适用M7(R2)指导原则。这一时间节点的设定,为药品研发和生产单位提供了清晰的指导,有助于他们及时调整研究方向和方法,确保药品的质量和安全性。
2. 强化生物技术产品病毒安全性评价


2024年5月22日,国家药品监督管理局(NMPA)正式发布了关于《Q5A(R2):来源于人或动物细胞系生物技术产品的病毒安全性评价》的公告(2024年第63号)。此次公告旨在通过引入和适用国际人用药品注册技术协调会的最新指导原则,进一步提升生物技术产品的病毒安全性评价水平。
公告明确要求,所有药品申请人在进行生物技术产品的研究时,需在现行药学研究技术要求的基础上,严格遵循Q5A(R2)指导原则的相关规定。这一要求将有助于确保生物技术产品在研发过程中能够全面评估和控制病毒安全性风险,保障最终产品的质量和安全。
公告指出,自2025年5月21日起(以试验记录时间点为准),所有与生物技术产品相关的研究均将全面适用Q5A(R2)指导原则。这一举措不仅为行业提供了明确的时间表,也为研发单位提供了充分的准备时间,以确保新指导原则能够顺利落地实施。
3. 药品分析方法研究须符合国际Q2(R2)/Q14标准


2024年5月28日,国家药品监督管理局(NMPA)正式发布公告(2024年第65号),正式采纳并适用《Q2(R2):分析方法验证》与《Q14:分析方法开发》两项国际人用药品注册技术协调会的指导原则。
公告明确要求,自公告发布之日起,药品研发申请者在进行药学研究时,必须在现有技术要求的基础上,遵循Q2(R2)和Q14的指导原则开展研究工作。
自2024年11月24日起(以试验记录的实际时间为准),所有相关研究将全面适用这两项指导原则。Q14指导原则为申请者提供了灵活的分析方法开发策略,申请者可以根据实际情况选择采用基础(即传统)方式、增强方式,或者部分结合增强方式进行。
此外,Q14还涵盖了分析方法的全生命周期管理与变更管理,其中可能涉及Q12指导原则中关于既定条件(EC)的相关内容。因此,对于提交同时涉及Q12相关内容的注册申请,申请者还需同时遵循并执行Q12的适用公告要求,以确保研发流程的合规性和申请材料的完整性。
二 2024年ICH最新指南发布动态
在推动全球药品研发与监管的标准化和协调化方面扮演着关键角色。2024年度ICH工作计划共发布了2024年正在活跃的协调议题,涵盖了有效性、质量、安全性和多学科等多个领域,ICH指导原则制修订过程一般分为5个阶段:
第1阶段构筑共识。
第2阶段,包括第2a阶段确认共识;第2b阶段采纳指导原则草案。
第3阶段监管机构征求意见和讨论。
第4阶段采纳指导原则。
第5阶段实施指导原则。
2024年度ICH指导原则拟制修订清单如下:
表1. 7个CIH指导原则将达到第4阶段采纳或最终交付
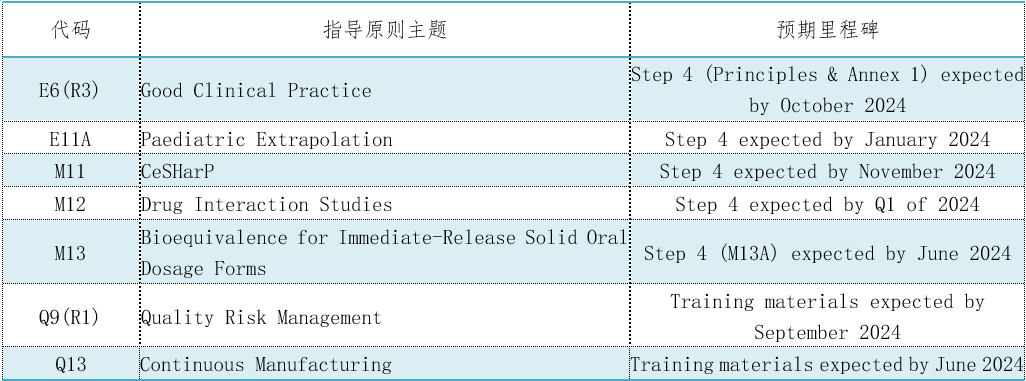
表2. 7个CIH指导原则将达到第2阶段
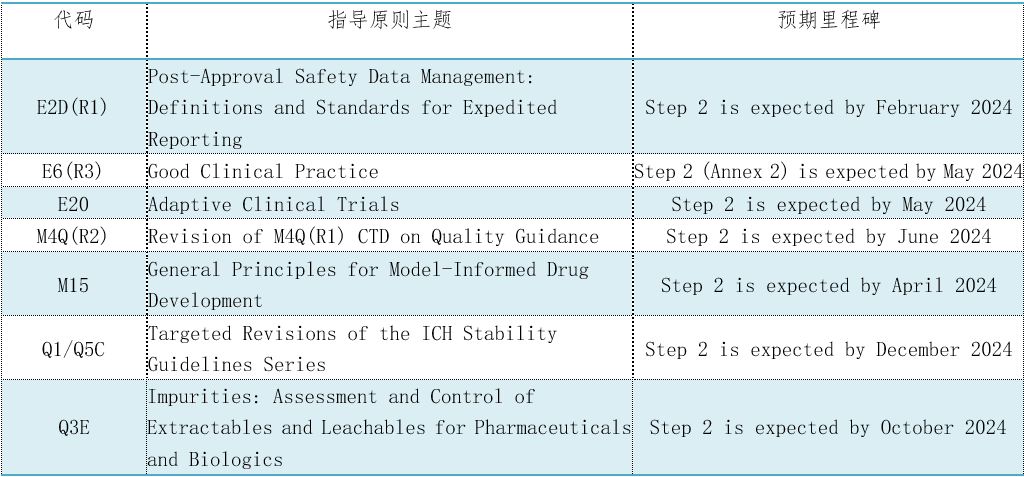
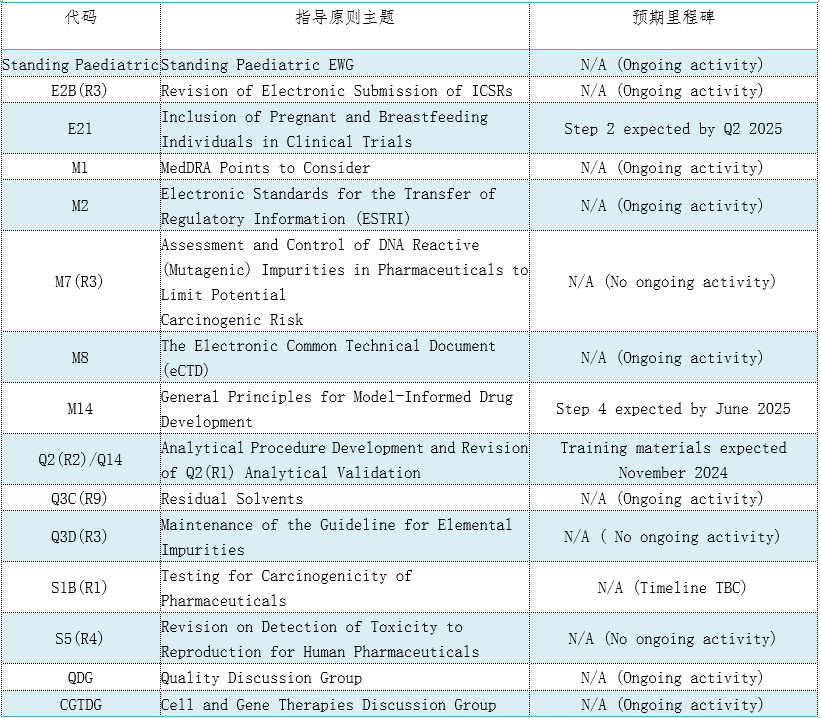
表3. 15个CIH指导原则将于2024年启用
编者按: ICH在2024年也持续推动药品研发与监管的标准化和协调化。通过发布活跃协调议题和指导原则制修订清单,ICH为药品研发与监管领域带来了新的发展机遇和挑战。监管机构和企业需要密切关注ICH的最新动态,积极参与指导原则的制定和实施工作,共同推动药品研发与监管的进步。
参考文献: [1] www.cde.org.cn、DIA、https://www.ich.org/
免责声明 本文系转载,仅做分享之用,不代表平台观点。图片、文章、字体版权等均属于原作者所有,如有侵权请告知,我们会及时处理。
原文链接:https://mp.weixin.qq.com/s/8KW5T_EPlny0PEY4_kktcQ
作者:滴水司南