文章来源:中国医药创新促进会 政策研究中心
2023年9月以来,国家药品监督管理局药品审评中心(下简称“药审中心”)与国家药品监督管理局食品药品审核查验中心(下简称“核查中心”)先后发布了《2022年度药品审评报告》《中国新药注册临床试验进展年度报告(2022年)》以及《2022年度药品检查工作报告》,相关报告梳理了2022年我国新药研发过程中注册、审评、药物临床试验以及注册核查等实施现状。
本文基于《2022年度药品审评报告》《中国新药注册临床试验进展年度报告(2022年)》,从注册申请受理量、药品上市前各阶段时间花费情况等角度对2022年新药研发情况以及存在的问题进行了分析。
从报告上看,2022年新药IND与NDA受理量、加快上市注册程序的申请量等总体呈现减少趋势,按时限审结率以及沟通交流会议接收数量继续增长[1]。同时报告也反映出创新药研发扎堆抗肿瘤药领域、临床试验启动时间过长、沟通交流会议仍需进一步完善等问题。
1
药品注册申请受理量变化趋势
1.1全年药品注册申请受理量增长,需技术审评的注册申请占比基本稳定
根据《2022年度药品审评报告》显示,2022年药审中心受理注册申请总量达12368件,继续延续增长趋势[2]。同时直接审批的技术申请(即无需技术审评的补充申请和临时进口注册申请)与需技术审评的注册申请(即IND、NDA以及ANDA等)占比基本稳定,其中需技术审批的注册申请占比约为3/4,直接审批的技术申请占比约为1/4。

图1 2017年至2022年注册申请受理总量(件)
1.2新药IND与NDA受理量有小幅下降
将创新药与改良型新药数据合并按新药进行计算。IND受理量方面,2022年中药、化学药品与生物制品IND受理量仍显著高于2020年前水平,其中化学药品与生物制品IND受理量较2021年有小幅下降,降幅分别为8.85%与1.28%[3]。NDA受理量方面,化学药品NDA受理量较2021年增长13.89%,生物制品减少38.71%,但仍高于2020年以前水平。此外,中药NDA受理量与去年持平。
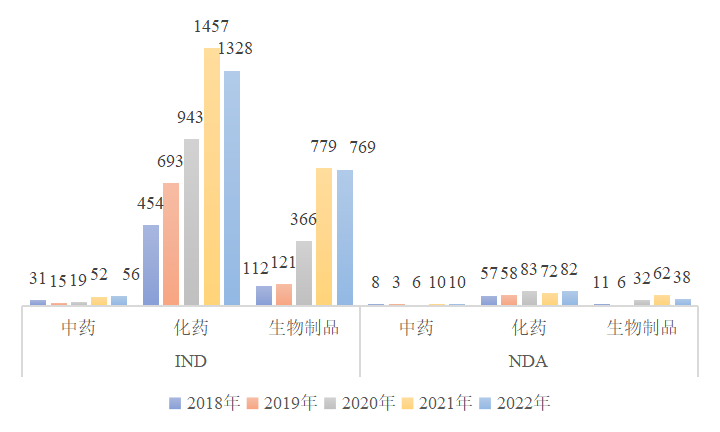
图2 2018年至2022年新药IND与NDA受理量(件)
2
药品上市前各阶段时间花费情况
2.1多数申请人可在2个月内完成首次临床登记提交
新药注册临床试验进展年报显示,2022年受理号登记平均用时为116天,但同时接近半数的申请人可在2个月内完成受理号登记与提交工作。BE备案登记方面,平均用时为67天,从数据上看近80%申请人可在1个月内完成登记与提交工作。
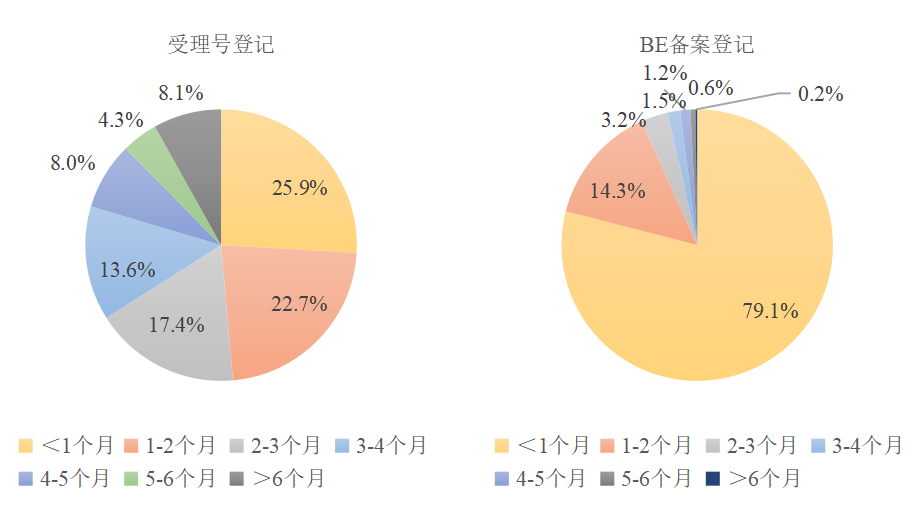
图3 2022年受理登记与BE备案登记用时占比
2.2部分申请人启动新药临床试验用时偏长
从启动临床试验用时上看,多数中药临床试验启动时间偏长,需1-3年才可启动。生物制品与化学药品启动临床试验所需时间较中药更短,两年来超半数药品可在6个月内启动临床试验。
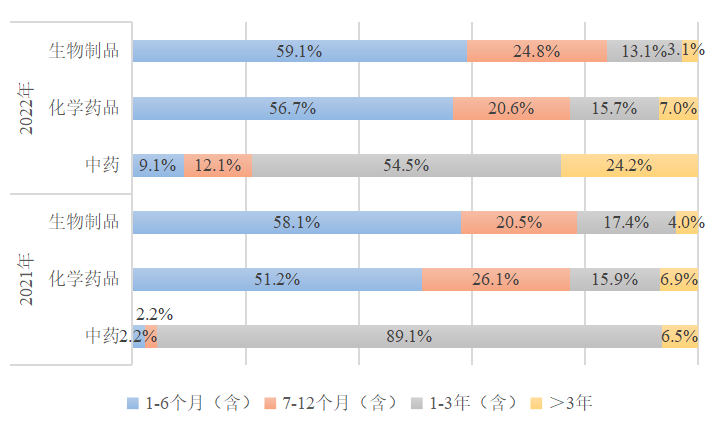
图4 2021年与2022年生物制品、化学药品与中药临床试验启动所需时间
2.3全年按时限审结率同比增长
从药品审评报告的数据来看,2020年NDA与优先审评审批的按时限审结率相对较低,其原因可能是受新冠肺炎疫情影响。2022年NDA与优先审评审批相较2020年有显著增长,2022年两者按时限审结率已超过98%。
自2018年以来,药审中心共发布了三批81个品种的临床急需新药目录,其中已有54个品种在我国提出注册申请,且都已获批上市,相关品种的按时限审结率三年来均为100%。
表1 2020年至2022年部分类别注册申请按时限审结情况

3
批准的IND与NDA适应症领域分布仍以抗肿瘤药为主
在治疗领域分布上,生物制品与化学药品批准的IND与NDA中抗肿瘤药物占据主要地位,此外皮肤与五官科药物、抗感染药物、风湿性疾病及免疫药物以及内分泌系统药物的IND与NDA批准量也相对较多。

图5 2022年建议批准的化学药品与生物制品IND治疗领域分布
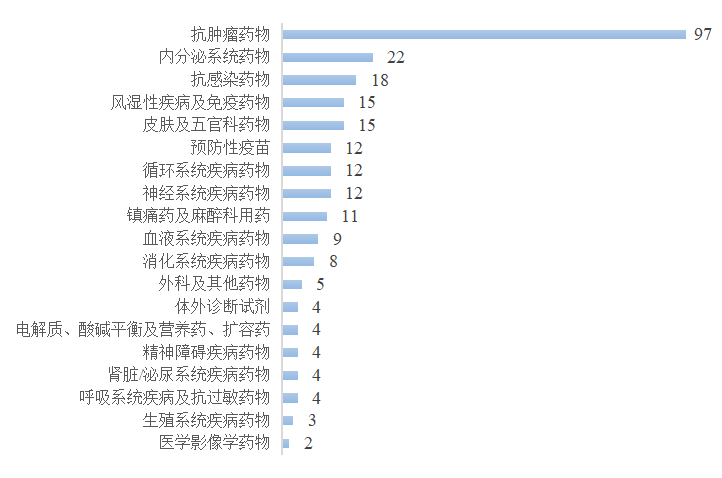
图6 2022年建议批准的化学药品与生物制品NDA治疗领域分布
4
加快上市注册程序申请量减少,突破性治疗药物程序日趋完善
2019年新修订药品管理法实施后,2020年新版《药品注册管理办法》中明确突破性治疗药物、附条件批准、优先审评审批以及特别审批四条药品加速上市程序。2022年,纳入附条件批准、优先审评审批、特别审批程序的申请件数均有所减少。

图7 2020年至2022年纳入四条加速上市程序的申请件数
同时近年来突破性治疗药物路径通过率也在逐年增加,2020年突破性治疗药物路径通过率仅16.33%,至2023年通过率已增长至28%。

图8 2020年至2022年突破性治疗药物受理及通过情况
5
沟通交流会议接收数量继续增长,会议申请与召开比例存在差异
2020年12月,药审中心发布的新版《药物研发与技术审评沟通交流管理办法》,对沟通交流程序进行了调整,并将《关于调整药物临床试验审评审批程序的公告》等文件中关于沟通交流的要求进行梳理,统一纳入本办法中。
办法同样将沟通交流会议分为Ⅰ、Ⅱ、Ⅲ三类,其中Ⅰ类会议适用于解决药物临床试验过程中遇到的重大安全性问题,以及突破性治疗药物研发过程中重大技术问题等情形,一般在申请后30日内召开。Ⅱ类会议适用于解决药物在研发关键阶段的技术问题,包括新药临床前会议、新药临床会议等8类,一般在申请后60日内召开。Ⅲ类会议为除Ⅰ、Ⅱ类会议外的其他会议,一般在申请后75日内召开。
2022年药审中心接收沟通交流会议申请继续保持增长态势,2022年接收沟通交流会议申请4924件,其中Ⅰ类会议840件(17%)、Ⅱ类会议3031件(62%)、Ⅲ类会议1053件(21%)。
从接收量上看,会议申请类型中新药临床前(Pre-IND)申请与Ⅲ类会议申请量最多,两者合计占比超50%,这也表明药企对这两类会议需求最大;另一方面从召开量上看,Ⅰ类会议与Ⅱ类会议中新药临床前(Pre-IND)会议召开量相对较大,两者合计超40%。
表2 2022年三类沟通交流会议申请量及召开量件数

表3 2022年II类沟通交流会议申请及召开占比

讨论
近年来药审中心与核查中心分别针对新药注册临床试验进展以及药品检查核查情况定期发布了年度报告,上述报告从审评、临床试验、检查核查等不同角度梳理了过去一年我国药品研发及注册审评情况,对指导药企研发、解决药品研发中共性问题、深化药品审评审批制度改革措施、加强药品监管能力等方面发挥了重要作用。
但另一方面,通过相关报告的梳理,也可发现当前我国药物研发过程中存在的一些问题,如创新药研发靶点扎堆、新药临床试验启动时间过长等,相关问题的解决也需监管、药企以及其他利益相关方的共同努力。
1 创新药研发仍存在靶点扎堆、“盯药”而非“盯病”情况,需政策进一步引导
从数据上看,目前我国IND与NDA治疗领域分布上仍以抗肿瘤治疗领域为主,其中近一半批准的IND其治疗领域为抗肿瘤,药智数据也表明2016至2022年间超70%的上市1类新药为抗肿瘤药物[4]。
但另一方面,2017年柳叶刀杂志发布的我国疾病负担前十名中,癌症仅肺癌、肝癌占据两席地位,中风、缺血性心脏病、慢阻肺病以及糖尿病等已成为影响我国居民伤残调整生命年(disability-adjusted life-years, DALYs)的主要因素。
2022年抗肿瘤药物研发过热现象已有所缓解。但实践中创新药研发与我国疾病负担情况间仍存在资源错配的现象,创新药研发依旧主要集中于抗肿瘤药物领域。创新药研发也需进一步的政策引导,以我国未满足的临床需求为导向,更加关注疾病负担较重、新药研发覆盖面较低的领域。
2 加强临床试验阶段沟通,打通新药上市“堵点”
从报告数据上看,临床试验登记阶段用时相对较短,且全年按时限审结率高于99%,新药上市“堵点”主要集中于临床试验启动阶段,有超40%的企业需花费7个月及以上的时间启动临床试验。同时有数据表明,临床试验启动过程所需花费的时间平均为6-12个月,启动过程中合同洽谈签署所需花费的时间平均为2-6个月,在临床试验启动过程中占比较大[5]。
临床试验提质增效,仍有多个堵点尚未打通,例如临床试验合同洽谈中,不同申办方、CRO以及临床试验机构使用的合同模板不同、申办方需与多个临床试验机构签订、修改合同等因素也极大的影响了洽谈效率[6];目前,临床试验和参与主体的信息资源尚未打通,申办方、GCP中心等信息不联通,大大延缓了临床试验进程。建议各主体探索推动通用临床试验合同模板的使用,以减少合同洽谈过程中合同审核、修订等所花费的时间,助力于提高临床试验启动效率,加强信息技术建设,大块推动药品早日上市,惠及患者。
3 进一步增加沟通交流会议资源配置
从接收数量上看,业内对沟通交流会议存在强烈的需求,但同时2022年沟通交流会议的平均召开/接收比为8.61%,多数申请的会议并未召开。面对业内迫切的需求,目前药审中心已在沟通交流公示栏目中常见一般性技术问题中对申请人的共性问题进行解答,避免申请人的重复咨询。另一方面,药审中心也可加大对沟通交流会议的资源投入,增加会议的召开数量和形式,以进一步满足业内对沟通交流会议的需求。
展望
自2019年新修订《药品管理法》出台以来,药审中心也发布了超200个指导原则指导药品研发上市,为解决药品研发与生产中的共性问题贡献了积极作用。未来随着《药品管理法实施条例》的出台,罕见病药品市场独占期、药品分段委托生产以及商业规模批上市销售等政策发布,也将进一步优化资源配置,鼓励企业参与新药研发,早日惠及更多的患者。
参考文献:
[1]国家药品监督管理局药品审评中心.2022年度药品审评报告[EB/OL].(2022-09-06)[2023-09-18]. https://www.nmpa.gov.cn/directory/web/nmpa//xxgk/fgwj/gzwj/gzwjyp/20230906163722146.html
[2]国家药品监督管理局药品审评中心.2021年度药品审评报告[EB/OL].(2022-06-01)[2023-09-18]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20220601110541120.html
[3]国家药品监督管理局药品审评中心.2021年度药品审评报告[EB/OL].(2022-06-01)[2023-09-18]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20220601110541120.html
[4]药智网.《研发投入破千亿、1类新药IND数量944个!2022年中国创新药研发报告》[EB/OL].(2023-06-02)[2023-11-02]. https://mp.weixin.qq.com/s/Jm1xsE36wnr0zH25TcDCtA
[5]房虹,汤骐羽,何静等.中美临床研究中心管理模式及启动效率的对比分析[J].中国新药杂志,2022,31(12):1195-1200.
[6]消化科空间.《临床试验合同签署耗时及其影响因素分析》[EB/OL].(2023-05-08)[2023-11-02]. https://mp.weixin.qq.com/s/GSdE64h8q3MrrVR3bkvYvQ
声明:本文内容仅提供信息性参考,不构成具体市场投资建议,也不可直接作为决策内容,中国医药创新促进会不对任何主体因使用文中内容所导致的任何损失承担责任。 政策研究精选
原文链接:https://mp.weixin.qq.com/s/nHpmlWB8VfSfxfQ6da3KMg