文章来源:米内网
近十年来,中国创新药产业得到了快速的发展和升级,创新药项目和临床试验数量都大幅增加,同时在靶点的创新性、药物形态和技术的多样性方面也有了显著的提高。这些变化使得中国创新药产业在国际上的地位逐渐提升。
本文基于国家药监局年度报告、公开数据文章、以及米内网新药研发与药品审评相关数据库的统计数据,以2013-2022年为时间维度,将在2023米思会上以展板形式发布报告,回顾国内近十年新药研发的宏观变化,并对其发展趋势进行汇总分析,以供参考。
药品审评进入良性循环,创新药、生物药申报量显著增加
根据CDE官网,自2015年启动药品审评制度改革,以及同年7月22日,国家食药总局发布临床试验数据核查公告(2015年第117号)开展临床试验项目自查后,国内申报临床和申报上市的受理号数量出现了断崖式的大跌。
秉承提高药品质量和鼓励创新,减少低水平重复的改革宗旨,以及仿制药一致性评价等举措的推动,自2016年起,CDE药品申报受理号数量逐步回升,中国药品审评申报进入了良性循环阶段,为近几年我国创新药物研发取得的进步,奠定了基础。
2013-2022年CDE申报IND与NDA受理号数量情况

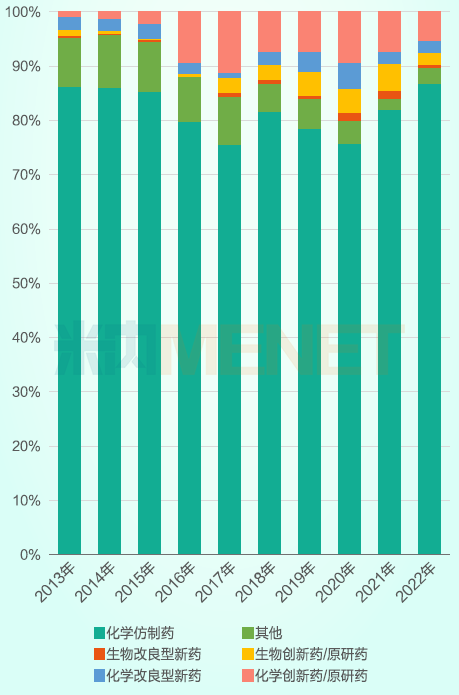
药政改革过后,中国创新药申报的比例显著增加。根据2013-2022年间的统计数据,创新药/原研药与改良型新药在申报上市的受理号中的占比提升非常明显,由2013年的不足5%,上升至如今的10%-20%。特别是化学创新药/原研药的占比,2016年以后较2015年之前增长了5-10倍。
2013-2022年CDE申报上市受理号中创新药及改良型新药占比
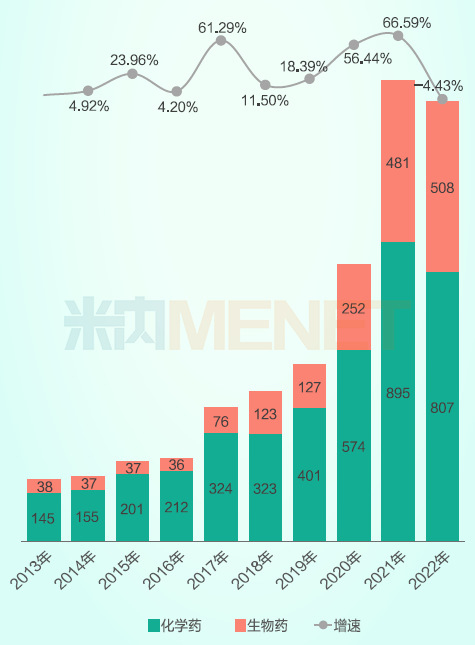
已获CDE受理的在研新药中,小分子化学药为主力军,但是大分子生物药近三年的申报数量显著增加。近十年CDE累计承办化学药和生物药1类新药申请5752件。2015年药政改革启动后,创新药IND申报数量开始增加,并在2017年出现了大幅增长的拐点,国产创新药的申报数量也明显增加。自2020年起,生物药1类新药申请数量呈明显上升趋势。
2013-2022年1类新药申请获CDE承办情况
IND申报数大涨40%,生物创新药热度不减
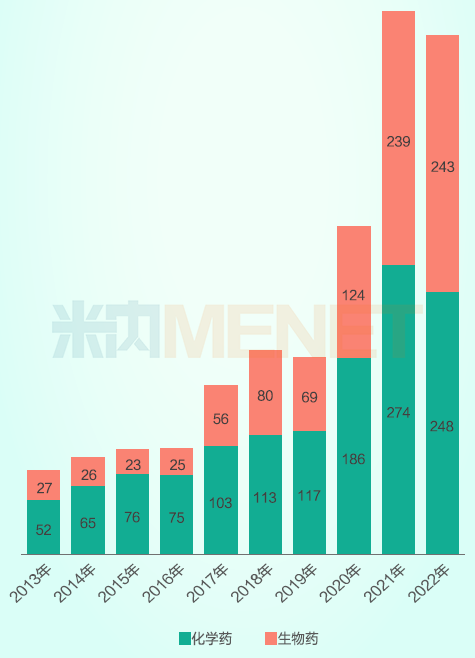
从首次提交IND的药物的类型上看,化学小分子药物研发仍然是主流,近十年来每年占比均超过50%,但从整体趋势看,生物创新药IND数量出现明显抬头,主要是国内企业在细胞疗法、基因疗法、小核酸药物等前沿疗法上紧跟国际前沿,维持着较高的热度,截至2022年,生物创新药与小分子创新药首次IND的占比已接近1:1。
2013-2022年中国1类新药首次IND数量
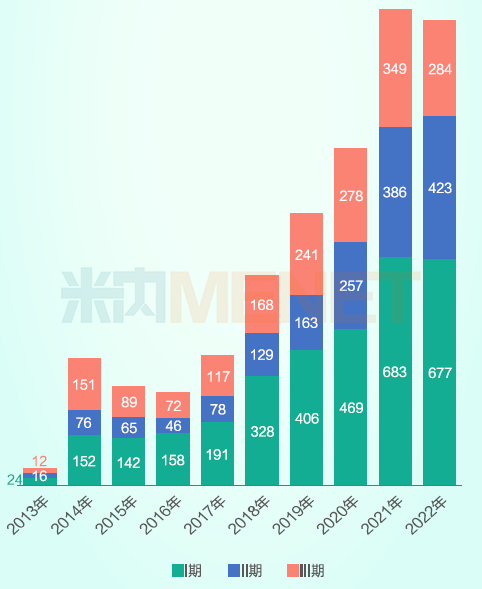
随着创新药IND申报数的增加,进入临床试验的新药数量也有明显提升。米内网中国临床试验数据库显示,2017年后在NMPA临床试验公示平台登记开展的临床试验数上了一个新台阶,2021年I至III期临床试验登记数合计达到1418件,同比增长超40%,2022年亦超过1400个,基本形成新常态。
从试验阶段来看,核心临床研究(以申报上市为目的的药物临床试验)占比越来越大。
2013-2022年中国按试验分期临床试验登记数量
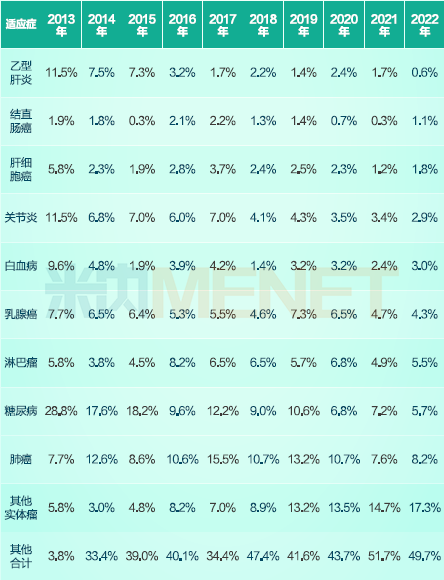
2013-2022年期间在NMPA临床试验公示平台登记开展I至III期药物临床试验涉及的适应症TOP10中,有7个与肿瘤相关。围绕TOP10适应症开展的临床试验数量,占临床试验总数的55%,其中有一部分是针对非小细胞肺癌、乳腺癌、肝细胞癌等高发疾病。同时,也有越来越多的创新药企在基因治疗、免疫治疗等领域进行探索。
2013-2022年间国内开展I至III期临床试验数最多的适应症TOP10
Fast-follow向渐进式创新转变,本土药企地位渐显
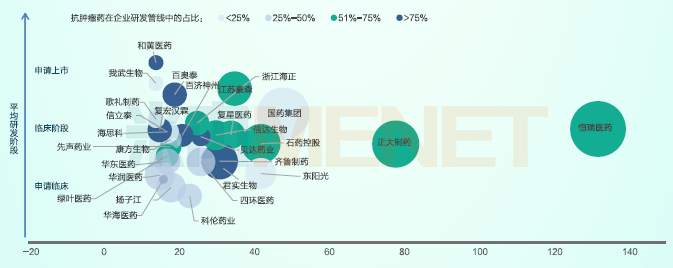
根据相关资料,近十年国内申报品种数量TOP30企业中,恒瑞、齐鲁、扬子江、正大制药等企业上榜,这些企业为满足患者临床用药需求,全面提升具有“安全、有效、经济”三项指标的药物的可及性,做出了重要贡献。
2013-2022年在CDE申报品种数量最多的企业TOP30

注:(1)按集团进行汇总统计,品种数量统计剔除原料药;(2)平均研发阶段为企业申报的所有药品在国内最高研发进度的加权平均值;(3)已上市品种数量为气泡大小;(4)申报品种含申报临床与申报上市、含创新药与仿制药。
总体而言,中国仍旧处于由快速跟进向渐进式创新转变阶段,头部企业效应逐步显现。从近十年创新药申报数量(按受理号统计)TOP30中国药企看,这些企业申报的创新药受理号数量占近十年所有企业申请创新药(含进口)数量的25%,其中恒瑞申报了130多个品种,遥遥领先于其他企业。除传统的bigpharma企业,近年来新兴的biotech企业(如君实、贝达、百济神州、歌礼、百奥泰、复宏汉霖、康方生物等)日益成为国内创新药研发的中坚力量。
2013-2022年在CDE申报创新药数量最多的企业TOP30
双抗、ADC.....新兴疗法成爆款,剑指HER2、EGFR等热门靶点
近十年中国首次IND的1类新药以小分子药物为主,但大分子药物及新技术药物数量的占比不断提高:2016年开始单抗类药物占比突破10%,2017年细胞治疗药物崭露头角并在2018年占比超过10%,近三年双抗、抗体偶联药物(ADC)以及细胞治疗产品新兴疗法占比逐渐增大。
2013-2022年国内1类新药首次IND数量

2021年热门靶点(申报药物数超过5个的靶点,下同)有13个,2022年有12个,EGFR和Claudin 18.2在这两年均排进前三。肿瘤仍是新药研发最热门的疾病领域,排名靠前的靶点主要为肿瘤相关靶点,例如Claudin18.2、HER2、PD-L1、EGFR等。
2021年国内申报新药品种数量最多的热门靶点
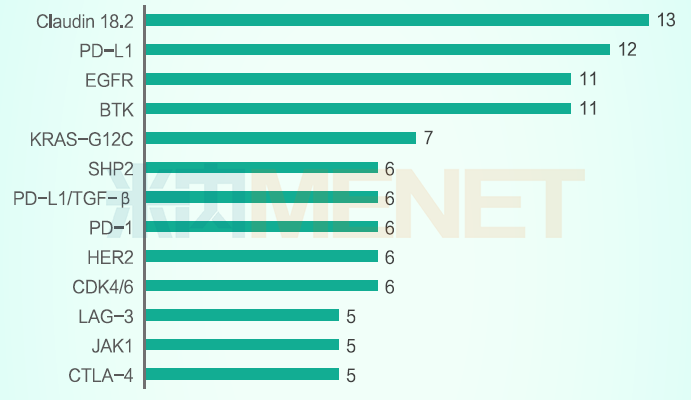
2022年国内申报新药品种数量最多的热门靶点

目前,国内在研药物靶点TOP5分别是:PD-(L)1、EGFR、HER2、CD19和GLP-1。其中,国内在研靶点TOP3:PD-(L)1、EGFR、HER2和全球在研靶点TOP3一致,同时,全球在研药物靶点TOP10,囊括国内在研药物靶点TOP5,可见中国药物研发脚步紧跟全球趋势。
全球在研药物数量最多的靶点TOP10及中国在研药物数量

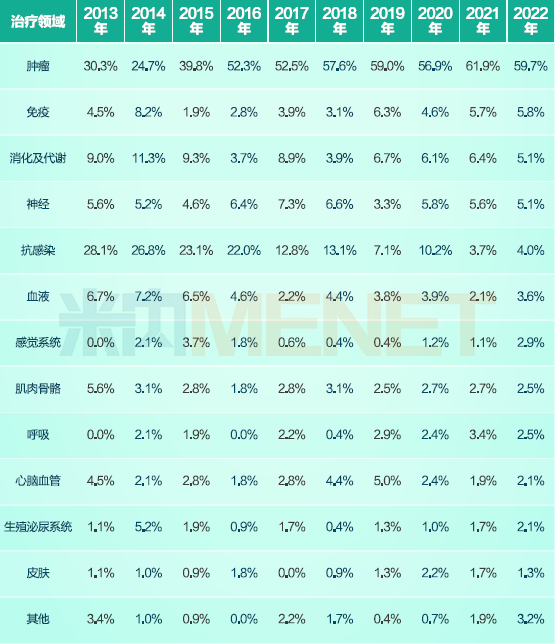
肿瘤领域一直是新药研发的重点领域,从2016年开始,抗肿瘤药每年占比均超过50%,早期研发的产品仍然以Me-too产品为主,但随着近年研发实力的提高,创新药开发模式也在发生改变,具有FIC(first-in-class)潜质的产品不断涌现。
当然,这种趋势转变也不能一概而论,毕竟在中国创新药中,真正意义上具备全球首创性的药物仍然不足。FIC在小分子领域可能会因为激酶的选择性差异导致多靶点药物的出现,从而提高了FIC药物数据;而在抗体领域,随着技术进步,双靶点、多靶点的组合抗体也在一定程度上提高了FIC药物数量。不过,先进技术型的创新药物占比不断提高也是事实。
2013-2022年国产IND和NDA的1类新药按治疗类别分布情况
审评审批再提速,国产1类新药迎丰收
为了鼓励创新药研发,CDE逐步加快药品的审评审批速度,1类新药的审评时长明显缩短。2018年后,1类新药的获批数量增长明显,中位审评时长为418-587天,平均获批时间在2年内。NMPA在年度报告中指出,2022年中国创新药的审批时间平均为17.7个月,相比2015年的34个月有了明显的缩短。
2013-2022年国产1类新药审评时长
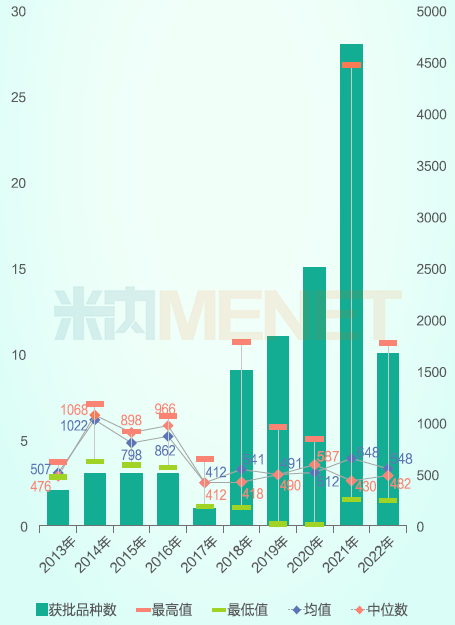
2013-2022年首次NDA的国产1类新药共有138个,其中化学药87个、生物药51个,生物药在近三年申报数量明显增加。CDE审评速度提升后,绝大部分获批上市的品种审评时间均在2年内,2020年之前NDA的1类新药绝大部分已获批上市,2022年申报的1款药物在当年即获批上市。
2013-2022年首次NDA的国产1类新药药物类型

2013-2022年首次NDA的国产1类新药审评情况
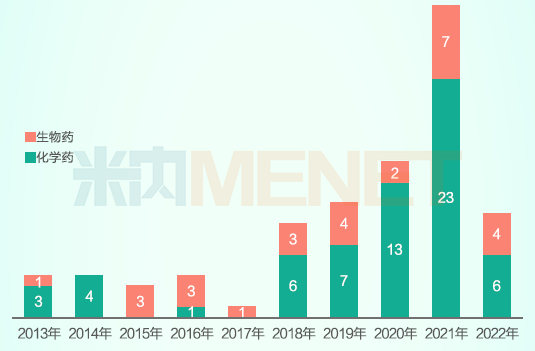
从首次获批的国产1类新药看,2018年以后其获批数量再上一个台阶;从获批新药的技术类型看,获批数量最多的依然是小分子化学药,约占已获批总数的三分之二。生物药方面,除了传统的疫苗、多肽、单克隆抗体,近年来开始出现双抗、ADC以及细胞治疗产品等新技术、新疗法产品。
2013-2022年首次获批国产1类新药药物类型
2013-2022年获批国产1类新药技术类型

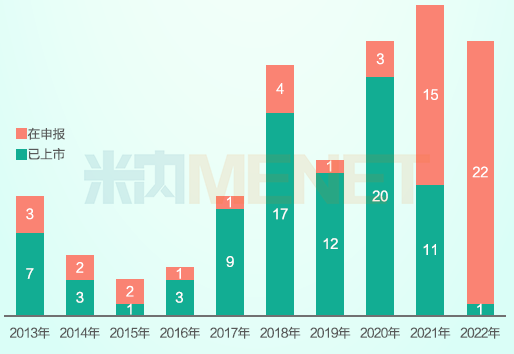
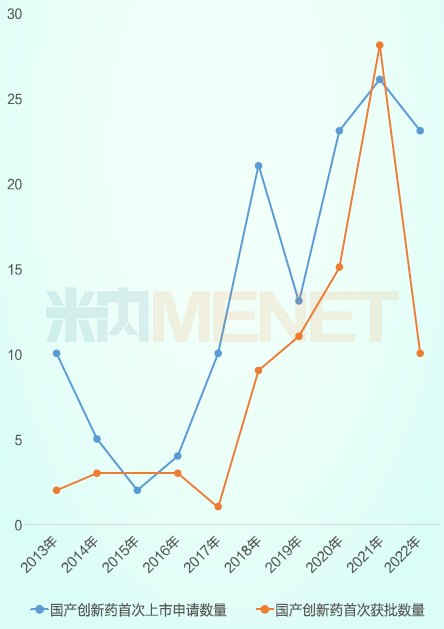
国产1类新药年度首次申报与年度首次获批方面,NMPA近十年间一共受理了138个国产1类新药的NDA申请,其中85个已获批。近年来,提交和获批的NDA数量正稳步增长,尤其在药政改革后,中国创新药批准数量显著增加,特别是2021年,当年获批的国产1类新药数量超过了当年申请NDA数量,为丰收大年。
2013-2022年国产1类新药首次申报与首次获批数
2013-2022年获批国产1类新药一览表(85个药品)



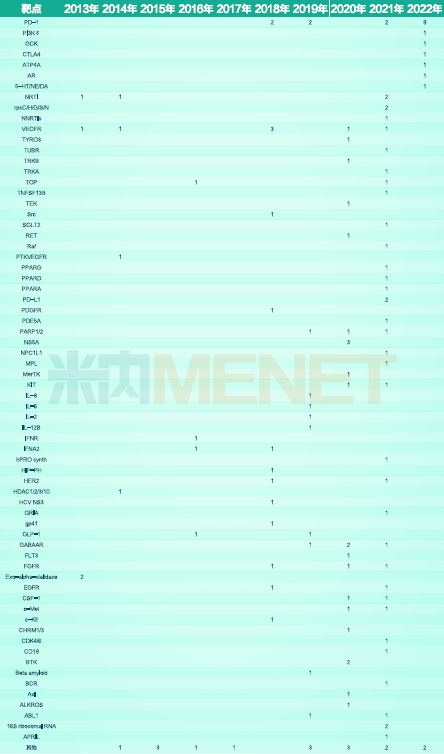
2013-2022年获批的国产1类新药涉及的近70种靶点情况
结语
总体而言,中国创新药在过去十年取得了令人瞩目的成就,并成为了全球医药领域的重要力量,其主要体现在研究方向、创新技术的突破以及市场规模不断扩容三大方面。当然,中国创新药发展过程中也存在着研发投入过高、创新人才短缺、研发项目扎堆雷同等不足,解决这些问题需要政策、企业、市场等多方面的共同努力。让我们一起加油,携手共勉!
数据来源:CDE官网、米内网数据库等
免责声明 本文系转载,仅做分享之用,不代表平台观点。图片、文章版权均属于原作者所有,如有侵权请告知,我们会及时处理。 图片 阅读 214 中国医药创新促进会 267篇原创内容 3个朋友关注 写下你的留言
原文链接:https://mp.weixin.qq.com/s/qfg0Exb27ppEa711DYKNDw