文章来源:中国医药报
党的二十大报告指出,必须坚持在发展中保障和改善民生,推进健康中国建设,把保障人民健康放在优先发展的战略位置。在我国,罕见病总体人群数量庞大、疾病负担重,该领域正越来越引起政府和社会的广泛关注。为维护患者健康权益,加强罕见病管理,提高诊疗水平,我国政府出台多项政策措施,鼓励罕见疾病药物的引进、研发、申报和生产。2018年发布的《第一批罕见病目录》(以下简称《目录》)为优化罕见病药物研发环境奠定了基础。然而,我国罕见病药物研发起步较晚,政策长期空白,市场存在不确定性,企业研发动力不足,罕见病药物获批数量较少。
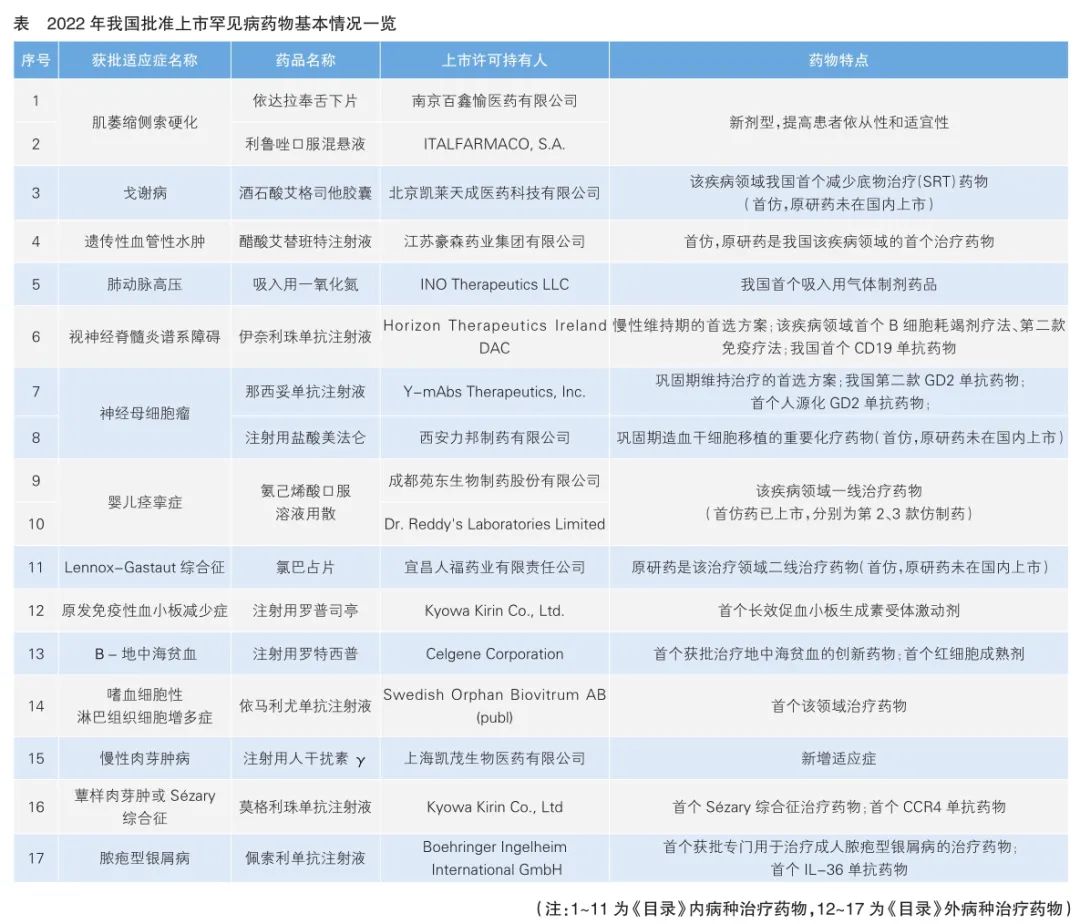
2022年蔻德罕见病中心和艾昆纬联合发布的《共同富裕下的中国罕见病药物支付》报告显示,全球共有7000多种罕见病,然而“有药可治”的罕见病病种仅有85个,中国“境内有药”的罕见病病种仅有68个。自2020年起,我国每年获批上市罕见病药物数量均超过15个,2022年共有17个罕见病药物获批上市。
本文试对国家药监局2022年批准的罕见病药物进行回顾和盘点。
一、产业发力 丰富罕见病药物类型
与往年相比,2022年我国批准上市的罕见病药物具有仿制药占比高、明确儿童适应症的药品占比高、国内企业参与形式多样、覆盖疾病种类多样等显著特点。
进口仿制双轮驱动,满足多方面临床需求
一是批准药品种类多,全年共批准进口药10个、国产仿制药6个、改良型新药1个。其中,生物制品8个、化学药品9个。二是覆盖多个重点领域,涉及神经、代谢、血液、心血管、皮肤等多种疾病治疗领域,明确包含儿童适应症的药品有11个。其中,《目录》内病种治疗药物11个。《目录》外病种治疗药物6个。三是多方面满足需求,4个进口药品直接填补我国相关疾病治疗领域临床空白,如依马利尤单抗是嗜血细胞性淋巴组织细胞增多症的首个治疗药物;2个进口药品提供了疾病关键期内的治疗方案,如伊奈利珠单抗主要用于治疗视神经脊髓炎谱系障碍,是慢性维持期的首选方案;3个新剂型提高了用药依从性和适宜性,如依达拉奉舌下片可以降低医疗资源占用,减少并发症,临床应用风险更可控,且用药方便,可以拓展更多治疗方案;3个首仿药品提高了药品可及性,如醋酸艾替班特的原研药是遗传性血管性水肿治疗领域的首个药物,费用高昂,仿制药获批后,原研药价格降低了48%。
国内企业积极参与罕见病药物研发、上市和商业化推广
长期以来,我国上市的大多数罕见病药物以进口为主,国产药研发主要集中在血友病凝血因子、凝血酶原相关药物。但从2022年获批的药品来看,国内企业积极承担社会责任,基于自身情况寻求差异化发展和布局,从不同赛道切入关注这一既往极少关注的人群。国内涌现了如李氏大药厂等企业,与境外中小型企业合作,引进开发和商业化多种境外已上市罕见病药品,同时这些企业也积极研发改良型新药、仿制药,多维度满足患者需求。
二、政策赋能 释放药审改革红利
2022年罕见病药物的加速获批是深化药审改革的成果。同时,多部门联合发力,制定发布了鼓励仿制药品目录、鼓励研发申报儿童药品清单、临床急需境外新药审评审批工作程序,为罕见病药物的审评审批、进口通关、医保准入、进院使用、知识产权保护等提供了有力保障,协同助力药品满足临床需求。
接收境外临床试验数据,加速临床急需药物批准
境外已上市药品的进口或仿制,是解决我国患者临床迫切需求药品可及性的重要手段。2020年起,国家药监局药品审评中心(CDE)发布了多项境外已上市境内未上市药品药学、临床试验等相关指导原则,有利于避免重复开展临床试验,降低研发成本,促进境内外企业合作。2022年获批的进口罕见病药品绝大多数豁免境内临床试验,境内外上市时间差约为3年。跨国药企也选择在我国同步布局多中心临床试验,进一步加速药品同步上市。如佩索利单抗是首个获批的进口1类生物药,企业在国际多中心临床试验结束后同步向中国、美国和欧洲提交上市申请,我国批准时间仅比全球首次批准(美国)晚100天。
制定指导原则,兼顾儿童用药开发 绝大多数罕见病为遗传疾病,且多在儿童生长发育关键期发病,病情随年龄进展,成为患者和家庭长期沉重的疾病负担。儿童患者生理复杂性和临床试验招募难等困境加剧了这一领域罕见病药物的研发。近年来CDE完善审评标准体系、加强沟通与交流,发布多项罕见病用药、儿童用药等技术指导原则。2022年获批的多数罕见病药物的适应症明确包含儿童人群。
急用先行,优先分配技术和审评资源
药品监管部门针对不同类别的药物建立了多条快速通道或成立工作组,推进临床急需药物进一步加速上市惠及患者。“快速通道”和临床急需境外新药审评审批工作程序为罕见病药物、儿童用药、临床急需药物等开辟“绿色通道”,合理配置审评资源,实现药品“急用先行”。仍以佩索利单抗为例,其在中欧同步提交上市申请,但在我国获批先于欧洲。
三、展望未来 罕见病药物研发机遇与挑战并存
首先,从全球来看罕见病药物仍有大量未被满足的需求。例如婴儿痉挛症和肌萎缩侧索硬化症,2022年获批的4款药品均为对症治疗,全球也尚无从源头根治的药物。婴儿痉挛相关疾病虽然有一些明确的致病基因,但境内还没有基因疗法的相关研究,境外也仅有少数药品进入到临床试验阶段;90%的肌萎缩侧索硬化患者发病原因尚不明确,亟需从基础研究层面突破。从产业角度来看,建议企业既要探索支持自身持续发展的经营之路,也要完成自主创新升级,真正以临床价值为导向,加强基础研究和合作,填补更多临床空白,或为患者提供更多选择。
其次,逐步突破《目录》限制,建立适宜的罕见病定义。2022年获批的《目录》外病种治疗药品相对《目录》内病种治疗药品的数量少、纳入医保的比例较小,缺少“清单”类政策支持。全球罕见病达7000多种,《目录》囊括病种有限,意味着《目录》外罕见病的患者和治疗药物无法享有相关激励政策和待遇,不利于实现公平性和保障患者健康权。罕见病目录不应成为“定义罕见病”的目录,应探索以患病率或患病人数等角度定义罕见病,使满足条件的药品即获得相应资格并适用相应政策。
最后,还需要多部门协同进一步激励获得罕见病资格的药品研发并惠及患者。近年来,我国已由多部门联合出台相关政策在进口罕见病药品方面发力,但仍需进一步建立适应中国国情的罕见病及药物研发激励机制,在国家层面制定相关政策进一步对获得罕见病资格的药品在研发、审评、医保准入方面予以支持。如在药品监管层面,落实药品试验数据保护和罕见病用药市场独占期制度;在医保层面,尽快探索建立罕见病药物的准入、价值评估方法、支付方式和多层次保障体系。
令人振奋的是,我国很多新兴生物技术企业已经开始布局罕见病领域,在中国开展的部分罕见病作用机制药物临床试验已经实现国际同步或全球领先。期待在政府、企业、患者和社会的多方努力下,我国更多原创罕见病药物尽早惠及中国和全球患者。
(本文发表于2023-02-25 《中国医药报》 02版 ● 国际罕见病日 专刊 ,作者系中国医药创新促进会政策研究中心研究员孙潭霖 )
原文链接:https://mp.weixin.qq.com/s/c1WSXP7bWfleRxTvEjjvmQ
作者:孙潭霖